CRISPR genom redigering: Chancer og udfordringer
Af Cord Herbert Brakebusch, BRIC, Københavns Universitet
Det er sjældent, at en molekylærbiologisk metode gør det til overskriften for tabloid aviser og politiske magasiner, men CRISPR genom redigering, en ny teknologi til at indføre definerede ændringer i genomet, har formået at gøre det. CRISPR har fremkaldt store forventninger til nye behandlingsformer for genetiske sygdomme samt frygten for ”designer babyer” med en ”perfekt” genom betalt af rige forældre eller faren for ”Frankenstein” forskere, som forsøger at spille Gud ved at skabe nye levende organismer. Er denne hype eller denne frygt begrundet? Hvad er muligheder, udfordringer og mangler ved denne nye metode? Og hvordan vil det påvirke dyreforsøg?
Nuklease-medieret genom redigering
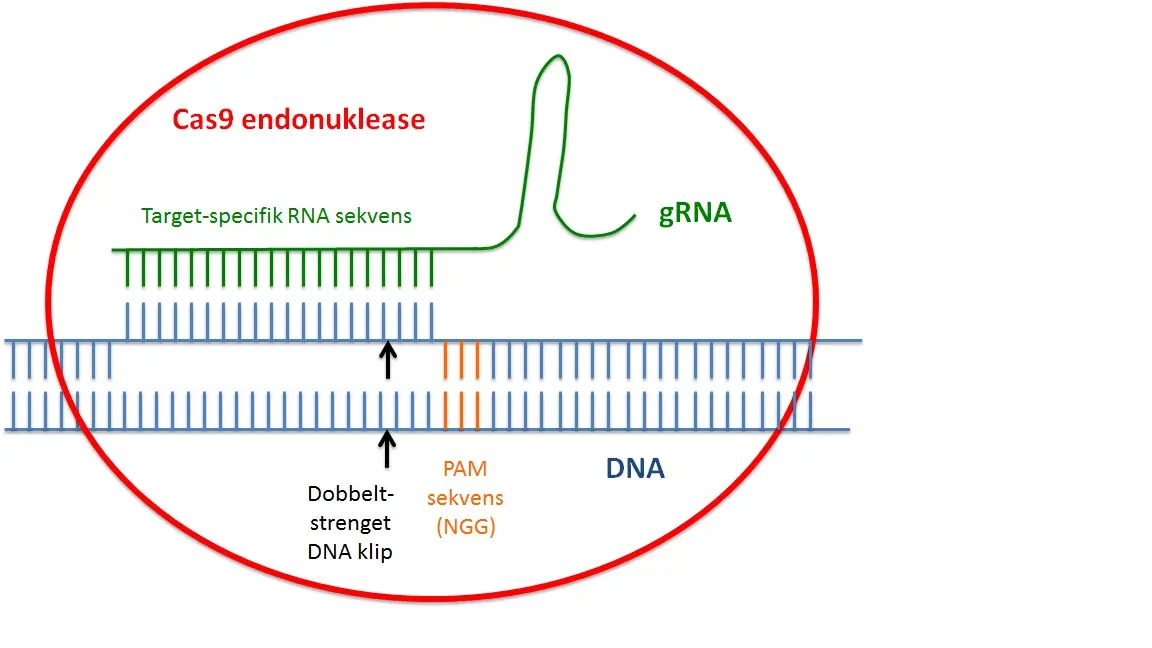
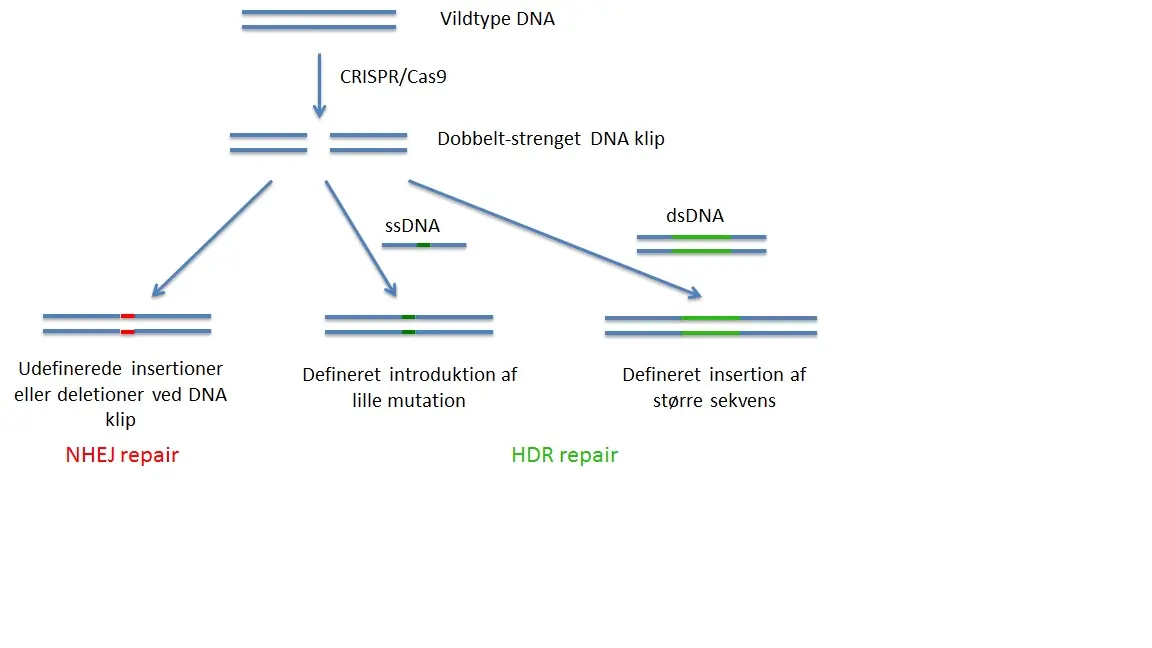
CRISPR genom redigering tilhører en gruppe af gen targeting metoder kaldes nuklease-medieret genom redigering. Ved disse metoder dannes et kunstigt enzym, som skærer det genomiske DNA i en levende celle, kun på et enkelt sted defineret af brugeren. Dette DNA snit vil derefter udløse forskellige typer af DNA-reparation, der vil forsegle læsionen og skabe i de fleste tilfælde en mutation. “Non-homologous end joining” (NHEJ) reparationen vil lukke hullet i en fejlbehæftet måde (Fig. 1), hvilket resulterer ofte i små deletioner eller insertioner, der kan forårsage geninaktivering (knockout), hvis de forekommer i den protein kodende region af et gen. Ved anvendelse af to CRISPR nukleaser kan man præcist slette genomiske sekvenser i mellem skærepunkter ved NHEJ reparation. Nylige undersøgelser rapporterede også NHEJ medieret indsættelse af exogent DNA ind i snittet site.
Mere subtile er en anden type reparation, “homologous directed repair”(HDR), som kræver tilstedeværelsen af et targeting-konstrukt. Denne targeting-konstrukt består af en DNA-sekvens, der skal indsættes flankeret af ”homologe” DNA-sekvenser, som er identiske med de, der flankerer det genomiske DNA-region, der skal erstattes (Fig. 1). Jo tættere stedet for indsættelse af fremmed DNA er til nuklease skæringssted, jo højere virkningsgrad af erstatningen. Denne fremgangsmåde kan anvendes til at erstatte DNA-sekvenser, til at indføre punktmutationer, eller indføre tags eller reportergener.
Generelt er effektivitet af HDR meget lavere end af NHEJ. Derfor vil selv ved tilstedeværelse af en targeting-konstrukt de fleste mutationer være medieret af NHEJ og kun få af HDR. NHEJ virker i alle celler, mens HDR er kun aktiv i visse faser af cellecyklus og generelt dårlig i differentierede, ikke-transformerede celler. Begge typer af reparation er effektive i zygoter af forskellige arter, herunder mus.
ZFNs, Talens og CRISPRs
Den første nuklease-medieret genom redigering blev udført ved zinkfinger nucleaser (ZFNs), hvor et DNA-skærende restriktionsenzym blev fusioneret med zinkfinger-domæner af transkriptionsfaktorer, der medierer binding til en specifik DNA-sekvens. Senere, TALE nucleaser (TALENs) blev udviklet og CRISPR nukleaser er nu det yngste medlem af denne type af kunstige enzymer. Hvad er så specielt ved CRISPR? Både ZFNs og TALENS er afhængige af genkendelse af en DNA-målsekvens ved en kunstigt fremstillet protein. Sådanne proteiner er relativt vanskelige at generere og nuklease-medieret genom redigering under anvendelse af disse enzymer er derfor både tidskrævende og dyr, som i væsentlig grad begrænser deres anvendelse i forskning. CRISPR nukleaser, derimod er afhængige af genkendelse DNA-målsekvens ved en kort, 20 nukleotider lang, komplementær RNA-sekvens (guide RNA), som kan udformes meget let for næsten ingen omkostninger (Fig. 2). Før CRISPR, nuklease medieret genom redigering var en teknik begrænset til nogle få elite laboratorier og store farmaceutiske virksomheder. Fremkomsten af CRISPR har gjort nuklease medieret genom redigering muligt for forskere inden for alle laboratorier, selvom de kun har begrænset erfaring med molekylær biologi.
Kimcellelinje genom redigering ved CRISPR i mus
CRISPR genome redigeret mus kan frembringes ved manipulation af zygoter, som udvikles direkte til mutante dyr. Ved anvendelse af zygoter fra genetisk modificerede mus kan CRISPR genom redigering gøres oven på eksisterende musestammer og dermed undgå omfattende parring af nyligt genererede genetisk modificerede mus med gamle stammer. Nuværende redigeringens effektivitet er høj for geninaktivering eller deletion ved NHEJ, men betydeligt lavere for indførelse af punktmutationer eller større DNA-sekvenser ved HDR. Desuden, hvis genom redigering finder sted efter den første celledeling af zygoten, opstår der mosaik mus, som kun i den næste generation giver anledning til mus indeholdende mutation i alle celler.
En alternativ fremgangsmåde er CRISPR genom redigering i embryonale stamceller, som effektivt kan screenes for den korrekte mutation in vitro og derefter at generere kimære mus ved ES-celle injektion i tidlige museembryoer. Parring af disse kimære mus med vildtypemus vil resultere i heterozygote mutante mus. Denne fremgangsmåde er lidt længere (1 måned for ES-celle manipulation + cirka 3 måneder for 1 mus generation), men mere effektivt og derfor billigere, især for komplekse eller multiple insertioner. Hvis omfanget af kimærisme er høj nok, kan fænotype analyse allerede være muligt i kimære mus. Indførelse af mutationer i ES-celler afledt fra sygdom modelmus kunne så være en hurtig måde til screening af virkningen af de tilsvarende mutationer i sygdomsmodel.
Hvis påføring af strenge kvalitetskrav for de genetisk modificerede ES-celler, er type, latens og incidens af tumor sammenlignelige i ES-celle-kimære og i konventionelle genetisk modificerede mus for småcellet lungecancer og mesotheliom modeller (Huijbers et al., 2015), som støtter gennemførligheden af denne fremgangsmåde.
Somatisk genom redigering ved CRISPR
CRISPR genom redigering kan også udføres i somatiske celler, for eksempel ved elektroporering eller viral transduktion. Her kan den lave genom redigering effektivitet af vævsspecifikke stamceller være en begrænsende faktor. Hvis de muterede celler har en vækst fordel, som for eksempel i kræftmodeller, er lav effektivitet ofte ikke et problem. For eksempel kan hydrodynamisk injektion af CRISPR-Cas9 og guide RNA udtrykkende plasmider i et volumen på 2 ml i halevenen anvendes til deletion af tumorsuppressorer specifik i leveren. Allerede få procent af muterede hepatocytter vil være tilstrækkelig til at forårsage tumorer i alle injicerede mus (Xue et al., 2014).
CRISPR genom-redigering i andre dyr end mus
Selvom CRISPR genom-redigering anvendes ikke kun i mus, men også i andre dyre, såsom C.elegans, zebrafisk, rotter, aber og svin. Faktisk også honningbier, kreaturer, og geder er blevet en del af den “CRISPR zoo”, hvilket indikerer, at denne teknik er bredt anvendelig i dyr.
Tidligere gen targeting var en dyr og risikabel affære. Nu er det relativt billig og meget pålidelig, hvilket gør det muligt at anvende det mere bredt, og også for at prøve meget komplekse og ambitiøse projekter, der involverer multiple mutationer.
Hvordan vil CRISPR genom-redigering påvirke brugen af dyr i biomedicinsk forskning?
Dyr er afgørende som in vivo modeller for komplekse humane sygdomme, der involverer forskellige celletyper og interaktioner af forskellige organer. Sådanne sygdomme, som for eksempel kræft og inflammatoriske sygdomme kan kun dårligt modelleres in vitro. Forskning i dyr forsøger at afsløre de molekylære mekanismer bag disse komplekse sygdomme og teste nye lægemidler og nye behandlingsformer. Alligevel er det diskuteret, om resultaterne fra dyr i tilstrækkelig grad kan oversættes til mennesker. Især for den mest udbredte modelorganisme, musen, har fordelen ved dyreforsøg for klinisk terapi været diskuteret i årtier uden at nå en konklusion. I nogle tilfælde viser lægemidler lignende virkninger hos patienter og mus, men i andre tilfælde er deres virkning artsspecifik. For eksempel eksperimentel autoimmun encephalomyelitis (EAE) er en musemodel for multipel sclerose (MS). Natalizumab, som inhiberer T-celle-migration til centralnervesystemet, er gavnlig både i EAE og MS, mens kombineret blokade af TNF, IL-23 og BAFF viste lovende resultater kun i EAE I mus, men ingen eller endog skadelige virkninger i MS-patienter (Procaccini, 2015).
Denne artsspecificitet er ikke kun relevant for sygdommens mekanisme, men også for metabolismen af lægemidler, der skal testes, som kan være ret forskellige i mus og menneske. En stor udfordring for den biomedicinske forskning er derfor at forbedre den prædiktive værdi af prækliniske musemodeller for terapi virkning og lægemiddel metabolisme hos mennesker. CRISPR genom redigering kan anvendes til at afhjælpe disse begrænsninger af den nuværende dyremodeller.
Humaniserede mus
For at øge validiteten af musemodeller CRISPR genom redigering kan dyrene gøres mere ligne lige med mennesker,. at ”humanize” dem. Dette omfatter udskiftning af sygdomstilstande relevante gen, som udviser en artsspecifik ekspressionsmønster, ekspressionsniveau, splejsningsvarianter eller protein-protein-interaktioner. Den let anvendelig CRISPR genom redigering gør det nu mere realistisk at mutere ikke kun 1 eller 2, men endog 10 eller 20 gener at øge ligheden mellem human og mus i et specifikt sygdomsmodel.
En anden strategi til humanisering er transplantation af humane vævsstykker eller vævsspecifik stamcelle i immunsupprimerede mus. Denne fremgangsmåde anvendes for eksempel til at studere patient-afledt cancer xenografter (PDX mus; Dobrolecki et al, 2016.), at overføre hæmatopoietiske stamceller, eller til at indsætte føtal lever, thymus og milt væv under nyrekapslen af mus (Shultz et al. 2012). Her kunne genom redigering af immundeficiente værtsmus yderligere at forbedre graftaccept ved at nedsætte transplantatafstødning eller graft-versus-host reaktion. Mutationer i værtsmus kunne også optimere samspillet af transplantatet med værten ved humanisere f.eks. værtsafledte vækstfaktorer, som fremmer transplantatoverlevelse eller ekspansion og differentiering af transplanterede stamceller. Transplantations effektivitet af humane celler kunne også forøges ved eliminering af den tilsvarende murine cellepopulation i værten ved genom redigering, som anvendt til eksempel til generering af mus med et humaniseret lever (Peltz 2013).
Alle disse fremgangsmåder lettes af den enkelhed af CRISPR genom redigering.
Validering af sygdomsassocierede gener
Genomsekvenseringsprojekter, der involverer et stort antal patienter og raske individer, gør det nu muligt at korrelere sygdomsmodtagelighed, sygdomsprogression og terapireaktionen med tilstedeværelsen af en eller flere genvarianter. Disse korrelationer skal valideres, inden de kan anvendes yderligere til diagnose, prognose, lægemiddeludvikling eller nye terapier. Genetisk modificerede mus er en fremragende model til at teste rollen for de genvarianter pågældende in vivo og CRISPR genom redigering i høj grad letter genereringen af sådanne mus, som indeholder et eller flere sygdomsassocierede genvarianter.
Faktisk kan sådanne mus også betragtes som nye sygdomsmodeller, som gælder især for patienter med den tilsvarende genetiske baggrund. Øget viden om, hvordan specifikke genvarianter bidrager til sygdommen vil gøre individuel behandling af hver patient muligt, baseret på tilstedeværelsen af specifikke genvarianter i sit genom, også kaldet personlig medicin eller præcision medicin.
Hvad er de aktuelle udfordringer i CRISPR genom-redigering?
En række algoritmer forsøge at forudsige on-target effektiviteten af CRISPR-Cas9 endonukleaser. Generelt dog synes skære effektiviteten af CRISPR endonukleaser at være vanskeligt at forudsige. Med den stigende mængde data, der er opnået på CRISPR genom redigering vil denne situation forhåbentlig forbedre i de kommende år.
CRISPR-Cas9 endonukleaser vil skære DNA ikke blot ved stedet komplementær til målsekvensen af guide RNA, men også på andre genomiske steder, som ligner, men ikke er identiske med målsekvensen. Computer programmer kan søge genomet for sådanne lignende sites og rang CRISPR guide RNAs på grundlag af sandsynligheden for off-target skæring. Men off-target skæring er ikke så let at forudsige, da ikke kun antallet af uoverensstemmelser er vigtig, men også deres placering i guide RNA, afstandene mellem uoverensstemmelser, og DNA sekvens af de overensstemmelser. Eksperimentelle tilgange rapporteret, at mange off-target sites ikke forudsiges af nuværende computerprogrammer. Men, generelt synes hyppigheden af off-target effekter ved CRISPR genom redigering til at være meget lav. En effektiv måde at yderligere nedbringe off-target skæring er anvendelsen af CRISPR ”nickases”, som i stedet for et dobbeltstrenget DNA-brud inducerer kun en enkeltstrenget DNA skæring. Kun hvis 2 ”nickase” CRISPRs skåret tæt på hinanden, vil en dobbeltstrenget DNA skæring skabes, hvilket resulterer i DNA-reparation og genom redigering.
Effektivitet af CRISPR genom redigering af HDR er forholdsvis lav, og i øjeblikket er den ”hellige gral” af CRIPSR forskning at finde måder at øge HDR effektivitet. Adskillige rapporter har offentliggjort betingelser der forbedrer HDR, men reproduktion af data er ofte vanskeligt og indtil nu ingen af de modificerede CRISPR genom redigering betingelser har fundet udbredt anvendelse. Forbedret HDR effektivitet er især vigtigt, hvis man ønsker at indføre flere mutationer i parallel.
Konklusion
CRISPR genom redigering er en sand ”game changer” i biomedicinsk forskning på grund af sin enkelhed, effektivitet, og relativt lave omkostninger. Den muliggør frembringelsen af ”humaniserede” musesygdomsmodeller med højere prædiktiv værdi end de eksisterende modeller. Med hensyn til dyrenes velfærd vil CRISPR genom redigering derfor bidrage til den 3R formål af “refinement” af dyremodeller. CRISPR genom redigering desuden muliggør hurtig validering af sygdom associeret gen varianter i in vivo modeller og dermed bane vejen for personlig medicin. Endelig er CRISPR genom redigering ikke begrænset til mus, men kan anvendes til andre arter af interesse inden for biomedicinsk forskning. Fordi CRISPR genom redigering er et højaktivt forskningsområde, forventes yderligere teknologiske forbedringer af forudsigelse af on-target og off-target effektivitet, og nye metoder til at forbedre HDR effektivitet i de kommende år.
Referencer
- Dobrolecki LE, Airhart SD, Alferez DG, Aparicio S, Behbod F, Bentires-Alj M, Brisken C, Bult CJ, Cai S, Clarke RB, Dowst H, Ellis MJ, Gonzalez-Suarez E, Iggo RD, Kabos P, Li S, Lindeman GJ, Marangoni E, McCoy A, Meric-Bernstam F, Piwnica-Worms H, Poupon MF, Reis-Filho J, Sartorius CA, Scabia V, Sflomos G, Tu Y, Vaillant F, Visvader JE, Welm A, Wicha MS, Lewis MT. Patient-derived xenograft (PDX) models in basic and translational breast cancer research. Cancer Metastasis Rev. 2016 Dec;35(4):547-573
- Huijbers IJ, Bin Ali R, Pritchard C, Cozijnsen M, Kwon MC, Proost N, Song JY, de Vries H, Badhai J, Sutherland K, Krimpenfort P, Michalak EM, Jonkers J, Berns A. Rapid target gene validation in complex cancer mouse models using re-derived embryonic stem cells. EMBO Mol Med. 2014 Feb;6(2):212-25.
- Peltz G. Can 'humanized' mice improve drug development in the 21st century? Trends Pharmacol Sci. 2013 May;34(5):255-60
- Procaccini C, De Rosa V, Pucino V, Formisano L, Matarese G. Animal models of Multiple Sclerosis. Eur J Pharmacol. 2015 Jul 15;759:182-91.
- Shultz LD, Brehm MA, Garcia-Martinez JV, Greiner DL. Humanized mice for immune system investigation: progress, promise and challenges. Nat Rev Immunol. 2012 Nov;12(11):786-98
- Xue W, Chen S, Yin H, Tammela T, Papagiannakopoulos T, Joshi NS, Cai W, Yang G, Bronson R, Crowley DG, Zhang F, Anderson DG, Sharp PA, Jacks T. CRISPR-mediated direct mutation of cancer genes in the mouse liver. Nature. 2014 Oct 16;514(7522):380-4.
Nyhedsbrev
Tilmeld dig Danmarks 3R-Centers nyhedsbrev.